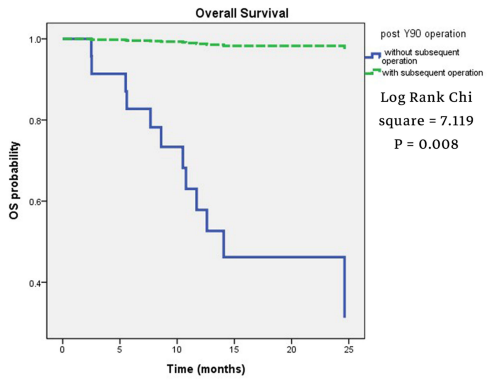
自2006年世界上第一个癌症疫苗——宫颈癌疫苗获得美国食品药品管理局(FDA)的批准上市以来,针对癌症疫苗的研究从未停止。目前,癌症疫苗可分为预防疫苗和治疗疫苗。预防疫苗最常见的就是HPV疫苗,而治疗疫苗目前也有不少进入临床。今天,我们就带大家看一下在肝癌领域,有哪些治疗性疫苗取得了不俗的疗效! 癌症治疗疫苗提高了免疫系统识别和摧毁抗原的能力。通常, 癌细胞在其表面上有某些分子被称为癌症特异抗原, 而健康细胞没有。当这些分子被赋予一个人时, 分子就会充当抗原。它们刺激免疫系统, 以识别和摧毁在其表面上有这些分子的癌细胞。大多数癌症疫苗也含有佐剂, 这些药物可以帮助增强免疫应答。 治疗性疫苗包括多肽、树突状细胞(DCs)、全细胞疫苗、溶瘤病毒和DNA制剂,这些可增加或实现对肿瘤抗原的特异性免疫应答。目前,一些多肽,如甲胎蛋白(AFP)、多药耐药相关蛋白3 (MRP3)和糖基蛋白3 (GPC3),已经被检测并被证明具有良好的耐受性和安全性。 甲胎蛋白(AFP)是肝细胞癌(HCC)中过表达的一种胎儿癌抗原。之前的研究证明,从AFP获得的HLA-A2限制性表位在体内外均具有免疫原性。研究人员利用先前鉴定的人AFP肽表位,创建了一种AFP表达的复制缺陷腺病毒,作为基于T细胞的免疫治疗的潜在靶点。 因此,作为一项I/II期试验(NCT00093548)的一部分,筛选有AFP+肿瘤且曾接受过HCC治疗的HCC患者,其中2例接受了疫苗接种。该临床试验表明,第一个病人有微弱的AFP特异性T细胞反应,并在9个月后复发,出现AFP表达的HCC。而第二个患者第二例患者出现了强烈的AFP特异性CD8+和CD4+细胞反应和AdV中和抗体反应,18个月后复发,血清AFP没有增加。此外,该疫苗具有良好的耐受性和安全性,没有明显的临床不良事件。这两名患者的观察结果支持在更大规模的临床试验中开发这种疫苗策略。 Glypican-3 (GPC3)是HCC组织中过表达的一种蛋白,但在健康成人肝脏中不存在。到目前为止,针对Glypican-3的各种免疫疗法已经被开发出来。 在一项I期临床研究(UMIN000001395)中,33例晚期HCC患者使用了GPC3衍生的肽疫苗,1例患者在开始治疗2个月后出现部分缓解,19例患者病情稳定。整体ORR为91%,中位PFS为3.4个月,中位OS显著改善,为9.0个月(95% CI: 8.0-10.0)。且CTL频率与OS显著相关,≥50为12.2个月,<50为8.5个月(P=0.033)。此外,与GPC3特异性细胞毒性T淋巴细胞(CTL)较少的患者相比,接种疫苗后GPC3特异性CTL增加,且报道显示疫苗耐受良好。 另一项II期研究结果显示,GPC3阳性患者接受辅助疫苗接种后,整体中位OS为20.1个月。41例接种疫苗的患者1年和2年的复发率为分别为24.4%和53.7%。与仅接受手术的80例患者相比,41例手术或射频消融联合疫苗接种的复发率更低(1年复发率24.4% vs 42.5%,p = 0.054;2年复发率53.7% vs 66.2%,p=0.198)。 多药耐药相关蛋白3 (MRP3)是一种载体型转运蛋白,是ATP结合盒式(ABC)转运蛋白的成员,其高表达与多种癌细胞相关。HCC组织中MRP3表达水平升高,显著高于非癌组织(p < 0.05)。无论肝功能、HCV感染状态、AFP水平和HCC分期如何,MRP3特异性CTL均可被激活。此外,研究证明MRP3在对索拉非尼毒性耐受的肝癌细胞中发挥重要作用,因此,MRP3是HCC免疫治疗中具有强免疫原性的肿瘤抗原的潜在候选抗原。 一项I期临床试验(UMIN000005678)研究了MRP3来源肽(MRP3765)作为疫苗在12例HLA-A24阳性HCC患者中的安全性和免疫原性。免疫耐受良好,整体ORR为72.7%,中位OS为14.0个月(95%CI:9.6~18.5)。 树突状细胞(DCs)是APCs,负责刺激T细胞和增强抗肿瘤免疫反应。树突状细胞在体外成熟和活化后被注射回病人体内。使用装载肿瘤细胞裂解物的树突状细胞疫苗的研究在小鼠模型中显示了抗肿瘤作用。与此同时,DC来源的外泌体形成了一类新的癌症免疫治疗疫苗,可触发强的抗原特异性抗肿瘤免疫反应,重塑肿瘤微环境。 一项I期研究对不能切除的原发性HCC患者进行自体树突状细胞免疫治疗,以评估免疫治疗的安全性和可行性。在这项研究中,80%的患者为肝细胞癌,而其余的患者则为胆管癌。作者报告免疫接种在所有患者中耐受良好,且未检测到明显的毒性。此外,一名患者的肿瘤缩小并在CT上显示坏死改变,而另外两名患者的血清肿瘤标记物水平在接种疫苗后下降。 另一项II期临床试验评估了肿瘤细胞裂解物致敏的树突状细胞(DC)作为佐剂对肝癌HepG2细胞系的杀伤作用。结果显示,使用这些改良的DCs是安全的,耐受性良好,并有抗肿瘤疗效的证据,在某些患者中产生抗原特异性免疫反应。35例患者中位生存期为5.5个月,6个月生存率为33%,1年生存率为11%。 Immunicum的同种异体树突状细胞疗法ilixadencel获得FDA授予的再生医学先进疗法(RMAT)称号,用于治疗转移性肾细胞癌(mRCC)。其在肝癌领域的研究也在进行中。 一项I期试验(NCT01974661)证实肿瘤内注射ilixadencel 无论是单药治疗还是联合索拉非尼治疗,都是安全的,并且与肿瘤特异性CD8+ T细胞增加有关。所有患者的中位PFS为5.5个月,中位OS为7.5个月。此外,与TACE联合应用时,DC灌注可增强肿瘤特异性免疫反应,但效果尚不足以预防HCC复发。 溶瘤病毒是一种工程病毒颗粒,可直接裂解肿瘤细胞,导致可溶性肿瘤抗原的释放,从而诱导抗肿瘤新抗原特异性CTL反应。 一项随机II期临床试验(NCT00554372)研究了在30例HCC患者肿瘤中注入低剂量或高剂量溶瘤病毒JX-594 (Pexa-Vec)的可行性。研究结果显示,高剂量组的中位OS明显长于低剂量组,分别为14.1个月和6.7个月(HR 0.39, p = 0.020)。最常见的不良反应是发热、身体僵直和呕吐的流感样综合征,所有患者均在治疗后的头几天内出现。 在另一项随机对照的IIb期研究中,先前接受过索拉非尼治疗的患者(NCT01387555),接受JX-594治疗的中位OS与接受最佳支持治疗的患者的中位OS没有显著差异(4.2 vs 4.4个月,HR 1.19 95% CI: 0.78 1.80;p=0.428)。 一例患者在注射肿瘤中表现出Pexa-Vec治疗的反应,该患者在治疗前(基线)、期间(干预)和治疗后23周的CT扫描显示,在第23周肿瘤的范围明显缩小。目前,正在进行一项III期研究(NCT02562755),比较JX-594序贯索拉非尼与索拉非尼治疗的疗效。 参考文献: Immunotherapy for Hepatocellular Carcinoma: A 2021 Update癌症治疗疫苗作用机制及类型

多款疫苗多项临床研究证实,肝癌疫苗前景广阔
1、甲胎蛋白(AFP)肽

2、糖基蛋白3(GPC3)


3、多药耐药相关蛋白3 (MRP3)

4、树突状细胞疫苗
5、树突状细胞疗法ilixadencel
6、溶瘤病毒